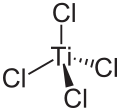
Titan(IV)-chlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titan(IV)-chlorid | |||||||||||||||
| Andere Namen |
Titantetrachlorid | |||||||||||||||
| Summenformel | TiCl4 | |||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende, an feuchter Luft stark rauchende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 189,71 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,728 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
136,4 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,6076 (18 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Titan(IV)-chlorid (Titantetrachlorid) ist eine chemische Verbindung aus Chlor und Titan. Das Titan liegt in TiCl4 in seiner höchsten und stabilsten Oxidationsstufe vor.
Es sind weitere Chlorverbindungen des Titans, darunter beispielsweise Titan(III)-chlorid, das ein starkes Reduktionsmittel ist, bekannt.[5]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Titantetrachlorid wird durch Carbochlorierung von Titandioxid in Gegenwart von Kohle und Chlor bei 700–1000 °C hergestellt:[1]
Es ist ein Zwischenprodukt des Kroll-Prozesses zur Herstellung von Titan.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Titantetrachlorid ist eine farblose Flüssigkeit, die bei Normaldruck bei 134,4 °C siedet.[6] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 6,79094, B = 1348,56 und C = 208,52 im Temperaturbereich von 40 bis 142 °C.[6] Titantetrachlorid hydrolysiert mit Wasser in einer heftigen exothermen Reaktion zu Titandioxid und Chlorwasserstoff. Es entsteht allerdings kein reines Titandioxid, sondern eine Wasser und Chlorwasserstoff enthaltende Additionsverbindung.[7][8]
Die Hydrolysewärme beträgt −295 kJ·mol−1.[8] Die Hydrolyse findet bereits bei Kontakt mit Luftfeuchtigkeit statt, wobei sich weiße Dämpfe aus Chlorwasserstoff über dem Stoff bilden.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Titantetrachlorid ist eine wichtige Lewissäure und wird in der Organischen Chemie in Knoevenagel-Reaktionen und der Mukaiyama-Michael-Reaktion verwendet. Es ist zudem Grundstoff für Katalysatoren, wie beispielsweise Ziegler-Natta-Katalysatoren, und Ausgangsstoff für Organo-Titan-Verbindungen. Titantetrachlorid findet in Raucherzeugern für militärische Zwecke Verwendung (Nebelkampfstoff). Titantetrachlorid tritt bei der Reinigung von Titandioxid („Chloridverfahren“) sowie bei der Titanherstellung („Kroll-Prozess“) als Zwischenprodukt auf. Es wird auch in der nass-analytischen Chemie zum Nachweis von Peroxiden benutzt. Bei Peroxidanwesenheit verfärbt sich die Lösung gelblich bis orange.
Wirkung im Körper
[Bearbeiten | Quelltext bearbeiten]Besonders beim militärischen Einsatz als Nebelkampfstoff besteht die Gefahr des Einatmens des entstehenden Chlorwasserstoffes HCl. Dieses kann zu Reizungen oder sogar Verätzungen der Schleimhäute oder des Lungengewebes führen. Erste Symptome beim Einatmen sind Husten und Brustschmerzen. Dauern die Symptome länger als 20 Minuten, ist mit einem lebensbedrohlichen Lungenödem zu rechnen, welches auch ohne anhaltende Symptome auftreten kann.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- ChemSub Online: Titan(IV)-chlorid
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Titanchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c d e f g h i Eintrag zu Titan(IV)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- ↑ Eintrag zu Titanium tetrachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Zur Bestimmung von Titandichlorid und -trichlorid in Alkali- oder Erdalkalichloridschmelzen, in Fresenius' Journal of Analytical Chemistry, 171/1959, S. 151–152
- ↑ a b Pike, F.P.; Foster, C.T.: Vapor Pressure and Boiling Point of Titanium Tetrachloride in J. Chem. Eng. Data 4 (1959) 305–306.
- ↑ a b Kapias, T.; Griffiths, R.F.: Accidental releases of titanium tetrachloride (TiCl4) in the context of major hazards—spill behaviour using REACTPOOL in J. Hazard. Mater. 119 (2005) 41–52, doi:10.1016/j.jhazmat.2004.12.001.
- ↑ a b Vechot, L.; Buston, J.E.H.; Kay, J.; Round, G.A.; Masharani, S.; Tickle, G.A.; Rowlands, R.: Experimental study of the liquid phase hydrolysis reaction of titanium tetrachloride. In: I. Chem. E. Symp. Series 156 (2011) 238–245.



![{\displaystyle {\ce {TiCl4 + 3H2O -> [TiO2*H2O*3HCl] + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4eec8490bbcf2ddb39dbad721730bc66a7518350)