Tropolone
Die Tropolone sind eine Gruppe von Naturstoffen, die sich vom 2-Hydroxytropon (α-Tropolon, kurz auch nur Tropolon[1]) ableiten.[2] Charakteristisch ist das siebengliedrige carbocyclische Ringsystem mit drei konjugierten Doppelbindungen, einer Carbonyl- und einer Hydroxygruppe (6π-Aromaten).
Einteilung und Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Das Grundgerüst des Siebenrings von α-Tropolons findet sich in manchen Naturstoffen. Der Name „Tropolone“ leitet sich von „Atropin“ ab und wurde 1945 von M. J. S. Dewar geprägt[1] für eine Gruppe von Oxyketonen, denen ein neuartiges Ringsystem zu Grunde lag.
Nach Nozoe[3] werden Tropolone vom Terpentyp, Hydroxytropoloncarbonsäuren, Purpurogallin und Tropolone vom Alkaloidtyp unterschieden.
- Tropolone vom Terpentyp: Zu den einfachsten Derivaten des Tropolons zählt das Hinokitiol (C10H12O2), auch β-Thujaplicin genannt, das im Holz verschiedener Zypressengewächse vorkommt, so in der taiwanesischen Hinoki-Scheinzypresse (Chamaecyparis obtusa var. formosana), aus deren ätherischem Öl (Hinokiöl) es 1935 von Tetsuo Nozoe in Taiwan isoliert wurde.[4] Daneben ist Hinokitiol ebenfalls im Holz des Riesen-Lebensbaums (Thuja plicata), im Hiba-Lebensbaum (Thujopsis dolabrata), im Zedern-Wacholder (Juniperus cedrus) sowie in weiteren Arten von Zypressengewächsen enthalten. Hinokitiol trägt zusätzlich eine Isopropylgruppe als Substituenten am Ringsystem und hat somit 10 C-Atome wie ein Monoterpen.
- Hydroxytropoloncarbonsäuren: Ein andersartiger Tropolonabkömmling ist die Stipitatsäure (C8H6O5), mit einer Carboxy- und einer weiteren Hydroxygruppe als Substituenten, die aus dem Schimmelpilz Penicillium stipitatum isoliert wurde. Auch die Tropolone Stipitatonsäure, Puberulasäure und Puberulonsäure werden von Penicillium-Arten gebildet.[5]
- Beim Purpurogallin (C11H8O5), das in verschiedenen Formen von Gallen wie Galläpfeln und in Rinden von Eichen vorkommt, ist das Strukturmotiv des Tropolons Teil eines bicyclischen Ringsystems.
- Tropolone vom Alkaloidtyp: Auch das Ringsystem von Colchicin, dem Hauptalkaloid von Colchicum autumnale (Herbstzeitlose), kann als komplexes Tropolon-Derivat betrachtet werden.[6]
-
Hinokitiol (β-Thujaplicin)
-
Bicyclisches Ringsystem von Purpurogallin
-
Colchicin
Stammverbindung α-Tropolon
[Bearbeiten | Quelltext bearbeiten]α-Tropolon ist das 2-Hydroxyderivat des Tropons und besitzt zwei Stellungsisomere mit gleicher Summenformel (C7H6O2). Beim α-Tropolon stehen Carbonyl- und Hydroxygruppe in 1,2-Stellung benachbart am Ring. Dies ermöglicht eine Keto-Enol-Tautomerie (siehe Abschnitt Eigenschaften), so dass es keines der üblichen Ketonderivate gibt.[1] Außerdem kennt man noch β-Tropolon (1,3-Substitution) und γ-Tropolon (1,4-Substitution), denen jedoch keine besondere Bedeutung zukommt.
| Tropolone | ||||||
| Name | α-Tropolon | β-Tropolon | γ-Tropolon | |||
| Andere Namen | 1,2-Tropolon, 2-Hydroxycyclohepta-2,4,6-trienon Purpurocatechol 2-Hydroxytropon TROPOLONE (INCI)[7] |
1,3-Tropolon 3-Hydroxytropon |
1,4-Tropolon 4-Hydroxytropon | |||
| Strukturformel | 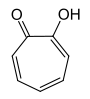
|

|

| |||
| CAS-Nummer | 533-75-5 | 3324-76-3 | 4636-39-9 | |||
| ? (Isomerengemisch) | ||||||
| PubChem | 10789 | 20751 | ||||
| Summenformel | C7H6O2 | |||||
| Molare Masse | 122,12 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Kurzbeschreibung | hellgelber Feststoff[8] | |||||
| Schmelzpunkt | 50–52 °C[8] | |||||
| Siedepunkt | 80–84 °C (0,1 mmHg)[8] | |||||
| pKs-Wert | 6,9[9] | 5,4[9] | ||||
| Löslichkeit | löslich in Wasser | |||||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | keine H-Sätze | siehe oben | siehe oben | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| keine P-Sätze | siehe oben | siehe oben | ||||
| Toxikologische Daten | 190 mg·kg−1 (LD50, Ratte, i.p.)[8] | |||||
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Oxidation von Cycloheptanon mit Selendioxid führt zu 1,2-Cycloheptandion. Die anschließende Bromierung-Dehydrobromierung im basischen Medium und eine Hydrierung führt zu α-Tropolon.[10]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Das α-Tropolon kommt in zwei tautomeren Formen vor, was durch Infrarotspektren belegt wurde. Da die tautomere Umwandlungsgeschwindigkeit sehr groß ist, wird ebenfalls eine Strukturformel mit einer Wasserstoffbrückenbindung postuliert. Der Wechsel des Protons von einem Sauerstoffatom zum anderen führt zugleich zu einer Verschiebung der π-Elektronen der Doppelbindungen, die in einem eben gebauten Siebenring mit 6π-Elektronen zur Ausbildung eines mesomeriestabilisierten Systems führt, der die Hückel-Regel erfüllt, also ein Aromat ist:

Reaktivität
[Bearbeiten | Quelltext bearbeiten]α-Tropolon lässt sich – wie viele andere Aromaten – nitrieren und bromieren. Es kuppelt mit Diazoniumsalzen. Durch Erhitzen wird es zu Benzoesäure isomerisiert.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c J. Falbe, M. Regitz (Hrsg.): RÖMPP Lexikon Chemie, 10. Auflage, Band 6: T - Z. Thieme, Stuttgart 1999, S. 4687 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Huber: Das Tropolon und seine Derivate. In: Angewandte Chemie, 1951, 63, S. 501–508; doi:10.1002/ange.19510632102.
- ↑ Tetsuo Nozoe: Natural Tropolones and Some related Troponoids. In: Fortschritte der Chemie Organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products / Progrès dans la Chimie des Substances Organiques Naturelles. Hrsg.: L. Zechmeister. Springer Verlag, Wien 1956 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ I. Murata, S. Itô, T. Asao: Tetsuo Nozoe: Chemistry and Life. In: Chemical Record. Band 12, Nr. 6, Dezember 2012, doi:10.1002/tcr.201200024, PMID 23242794.
- ↑ R. Hegnauer: Chemotaxonomie der Pflanzen, Band I. Springer Verlag, Basel 1962, S. 127 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Colchicin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2020.
- ↑ Eintrag zu TROPOLONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- ↑ a b c d e Datenblatt Tropolone bei Sigma-Aldrich, abgerufen am 13. Mai 2017 (PDF).
- ↑ a b J.S. Siegel, Y. Tobe (Hrsg.): Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 45a: Monocyclic Arenes, Quasiarenes, and Annulenes. Thieme, Stuttgart 2009, S. 364 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 619–620.


